Mathias Baumann Melberg, Lege i spesialisering, Hjerteavdelingen, Stavanger universitetssykehus.
Artikkelen er basert på studentoppgave ved Universitet i Bergen. Den er tidligere trykket i Hjerteforum nr 1 2017 og trykkes med tillatelse.
Veileder: Dennis Nilsen. Biveileder: Tor Melberg.
Det er estimert at akutte myokardinfarkter kompliseres av kardiogent sjokk i 5–15 % av tilfellene (avhengig av hvilken definisjon som brukes), med en liten nedgang i hendelser de senere år (1–4). Behandling av akutt hjerteinfarkt har forbedret seg drastisk de siste tiår. Mortaliteten for pasienter med akutt hjerteinfarkt uten kardiogent sjokk er redusert fra 30 % til < 5 % (5). Når det gjelder behandling av kardiogent sjokk, har ikke fremskrittene vært like store. Kardiogent sjokk er den ledende årsaken til død ved hjerteinfarkt, med en inneliggende mortalitetsrate på rundt 50 % (4, 6, 7, 8). Vi ønsket å oppsummere aktuell kunnskap om og behandling av kardiogent sjokk, samt redegjøre for evidensen til de ulike behandlingsmodalitetene utover medikamentell behandling.
![]()
Forbedret prehospital logistikk og døgnbemannet, hurtig perkutan koronar intervensjon (PCI) har redusert mortaliteten ved kardiogent sjokk, og gjort mekanisk støttebehandling tilgjengelig for store pasientgrupper. Intra-aorta-ballongpumpe (IABP) er den vanligste og mest tilgjengelige mekaniske støttebehandlingen som brukes ved kardiogent sjokk, men det mangler evidens for behandlingens nytteverdi. Det samme gjelder nyere behandlingsmodaliteter som ekstrakorporal membranøs oksygenering og mekanisk støttebehandling for venstre ventrikkel (for eksempel Impella®). Dødeligheten for nyere studerte kohorter ligger fortsatt rundt 40- 50 %. En nyere retrospektiv studie fra Massachusetts, USA, som studerte hjerteinfarkt-pasienter som utviklet kardiogent sjokk etter innleggelse mellom 2001-2011, viser lavere mortalitetsrate i nyere tid: 47,1 % døde i 2001/2003, 42,0 % døde in 2005/2007 og 28,6 % døde in 2009/2011. Gjennomsnittlig mortalitetsrate for hele perioden var 41,4 %, mens insidensraten var stabil (gjennomsnitt 3,7 % for hele perioden) (9).
Metoder
Opprinnelig ble det utført litteratursøk for perioden 2012-2014 som en del av særemne/originalartikkel om IABP under medisinstudiet ved Universitetet i Bergen. Søk ble gjort i MEDLINE, PubMed og Cochrane. Dette ble oppdatert med nye søk for 2015-2016. UpToDate har også blitt benyttet. Søkeord er: Myocardial infarction, acute coronary syndrome, cardiogenic shock, intra -aortic balloon pump, Impella® og ECMO.
Definisjoner
Kardiogent sjokk er en kompleks tilstand karakterisert av inadekvat perfusjon av endeorganer grunnet redusert hjerteminuttvolum og forårsakes oftest av akutt hjerteinfarkt. Klinisk kjennetegnes kardiogent sjokk av hypotensjon og nedsatt perfusjon av endeorganer.
Hemodynamisk defineres kardiogent sjokk som:
(1) systolisk blodtrykk < 90 mm Hg med varighet over 30 minutter (med adekvat fylningstrykk) eller at det trengs vasopressorterapi for å opprettholde et systolisk blodtrykk ≥ 90 mm Hg, (2) reduksjon av hjerteindeks (≤ 1,8 l/min/m uten støtte og 2,0 -2,2 l/min/m med støtte, igjen avhengig av anvendt definisjon) og (3) øket fylningstrykk i venstre ventrikkel (pulmonalkapillært kiletrykk > 18mm Hg) (7, 9).
Redusert gjennomblødning til endeorganene kan manifestere seg klinisk ved (1) kjølige ekstremiteter grunnet sentralisering, (2) nedsatt urinproduksjon (< 30 ml per time) og (3) endring av mental status. For å stille diagnosen kardiogent sjokk er det ikke nødvendig med invasiv måling av fylningstrykket i venstre ventrikkel og minuttvolum med arterielt pulmonalkateter. Diagnosen kan stilles klinisk ved vurdering av blodtrykket sammenholdt med kliniske tegn til lungeødem og hypoperfusjon (5, 7, 10). Serum-laktat kan også benyttes til å vurdere i hvilken grad den perifere mikrosirkulasjonen er nedsatt (11, 12). Den hemodynamiske dysfunksjonen kan variere fra mild hypoperfusjon til alvorlig sjokk, og graden av forstyrrelse er direkte relatert til kortidsutkomme (13).
![Kardiogent sjokk Diagnostiske kriterier:]()
Årsaker
Akutt hjerteinfarkt med påfølgende venstre ventrikkelsvikt p.g.a. myokardskade er den hyppigste årsaken til kardiogent sjokk. Komplikasjoner ved hjerteinfarkt kan også bidra til utviklingen av kardiogent sjokk. De viktigste komplikasjonene er de mekaniske: Ventrikkelseptumruptur, ruptur av fri vegg og papillemuskelruptur eller -dysfunksjon. Disse tilstandene forårsaker rundt 12 % av alle tilfeller av kardiogent sjokk, og ventrikkelseptumruptur har den høyeste mortalitetsraten (87 %). Mekaniske komplikasjoner bør mistenkes ved non-anteriore hjerteinfarkt med kardiogent sjokk, særlig hvis pasienten gjennomgår sitt første infarkt (14). For å utelukke slike komplikasjoner er ekkokardiografi et diagnostisk førstevalg; med mindre pasienten skal hastes til PCI. I tillegg kan blødning, infeksjon og/eller tarmiskemi bidra til sjokk under akutt hjerteinfarkt.
Tilstander som forårsaker akutt, alvorlig venstre og/eller høyre ventrikkelsvikt kan føre til kardiogent sjokk: Takotsubo-kardiomyopati (kjent som stressindusert kardiomyopati) og akutt myokarditt kan føre til kardiogent sjokk. Underliggende hypertrofisk kardiomyopati kan forverre hypotensjon/sjokk av andre årsaker, for eksempel sepsis eller hypovolemi. Det kliniske bildet ved disse tilstandene kan likne iskemisk hjertesykdom: Sjokk, stigning av hjerteinfarktmarkører (CK-MB, troponin T/troponin I) og ST-elevasjon. Andre viktige årsaker til kardiogent sjokk inkluderer akutt klaffeinsuffisiens (hyppig forårsaket av endokarditt eller chordaruptur som følge av skade og eller degenerativ sykdom), aortadisseksjon kombinert med akutt hjerteinfarkt eller klaffesykdom, hjertetamponade og lungeemboli.
Kjente risikofaktorer for utvikling av kardiogent sjokk ved akutt hjerteinfarkt inkluderer høy alder, fremreveggsinfarkt, hypertensjon, diabetes mellitus, omfattende koronarsykdom, tidligere akutt hjerteinfarkt eller angina pectoris, kronisk hjertesvikt, ST-elevasjons hjerteinfarkt (STEMI) og venstre grenblokk (15). Det er blitt rapportert om høyere insidens blant kvinner (4). Blant pasientene som utvikler kardiogent sjokk etter innleggelse, finner man oftere ved første undersøkelse raskere hjerterytme og lavere blodtrykk (14).
Patofysiologi
Kardiogent sjokk er en konsekvens av forstyrrelser i hele det sirkulatoriske systemet. Det er en kompleks og ikke fullt ut forstått tilstand. Nedsatt venstre ventrikkelfunksjon fører til systolisk og diastolisk dysfunksjon og er i de fleste tilfeller den primære årsaken til kardiogent sjokk. Det er likevel viktig å være klar over at andre komponenter i sirkulasjonssystemet bidrar. Et dødelig utkomme er vanligvis et resultat av tre nært beslektede faktorer: Multiorgandysfunksjon, progressivt forverret hemodynamikk og utvikling av systemisk inflammatorisk responssyndrom (SIRS) (16, 17).
Akutt hjerteinfarkt forårsaker systolisk dysfunksjon som igjen fører til nedsatt slagvolum og minuttvolum. Systolisk og diastolisk dysfunksjon medfører lungeødem som forverrer den pågående hypoksemien og iskemien. Nedsatt minuttvolum og hypotensjon gir systemisk og koronar hypoperfusjon. Hypoperfusjonen fremmer iskemi, celledød og medfører perifer vasokonstriksjon. Frigivelse av katekolaminer kompenserer til en viss grad det sviktende hjertet ved å øke myokardial kontraktilitet og perifer blodgjennomstrømning, men på bekostning av øket myokardialt oksygenbehov og fare for arytmi. Vasokonstriksjon kan føre til midlertidig hemodynamisk forbedring, men det øker også afterload og er vanligvis utilstrekkelig. En forklaring på den begrensede effekten av vasokonstriksjon er at infarktet og celleiskemi disponerer for utvikling av SIRS, som forårsaker uønsket vasodilatasjon og redusert systemisk vaskulær motstand. Det er ikke forstått hvorvidt denne inflammatoriske responsen spiller en kausal rolle eller er en konsekvens av vaskulær dysfunksjon. Et relatert fenomen er uhensiktsmessig produksjon av nitrogenoksyd (NO) og peroksynitrat som følge av økt ekspresjon av induserbar og endotelial NO-syntetase (iNOS og eNOS respektivt). NO er en negativ inotrop substans som forårsaker vasodilatasjon og forstyrrer katekolaminenes effekt. Andre kjente inflammatoriske markører som deltar i kardiogent sjokk, inkluderer interleukin-6 og tumor nekrosefaktor.
Det er viktig å ta hensyn til iatrogene årsaker til kardiogent sjokk da store registre viser at omtrent ¾ av tilfellene med kardiogent sjokk relatert til akutt hjerteinfarkt utvikler seg etter innleggelse på sykehus (18, 19). En rekke av medikamentene som brukes under behandling av hjerteinfarkt, er assosiert med en liten sjanse for utvikling av kardiogent sjokk: Beta-blokkere, ACE-hemmere eller beslektede angiotensin II-reseptorblokkere og morfin. Selv om risikoen assosiert med bruk av disse medikamentene er liten, vil et høyt pasientvolum i sum gi et betydelig antall hendelser (14). Særlig under behandling av pasienter med høy risiko for å utvikle kardiogent sjokk er det plausibelt at medikamenter som betablokkere og ACE-hemmere kan bidra negativt. En annen viktig gruppe medikamenter er diuretika. Diuretika har blitt mistenkt for å ha både en kausal og bidragsytende effekt relatert til utviklingen av kardiogent sjokk ved akutt hjerteinfarkt (15, 16). Under akutt hjerteinfarkt nedsettes venstre ventrikkels ettergivelighet, hvilket er en hyppig årsak til lungeødem. Sammenfallende ser vi en redistribusjon av det intravaskulære volumet ettersom den intravasale væsken lekker inn i lungene og forårsaker et plutselig fall i det sirkulerende plasmavolumet hos pasienter som ikke lider av kronisk hjertesvikt. Høye doser diuretika forverrer denne situasjonen ved å fremme videre tap av plasmavolum. Tilførsel av store væskemengder intravenøst kan føre til stuvning og bidra til utviklingen av kardiogent sjokk.
Blødning under hemodynamisk stabile hjerteinfarkt har tidligere vært knyttet til økt mortalitetsrisiko (20, 21). Dette er særlig interessant under behandling av kardiogent sjokk, da blødning ofte blir behandlet med blodtransfusjoner, som i seg selv er assosiert med forhøyede mortalitetsrater under akutt koronarsyndrom. De komplekse mekanismene bak dette fenomenet er ufullstendig kartlagt. (14, 22).
![]()
Behandling
Generelle støttetiltak:
Tilførsel av væske for å korrigere hypovolemi, stabilisere pasienten og oppnå optimalt fylningstrykk er indisert for alle pasienter med kardiogent sjokk. Det er dog ingen gode randomiserte data som understøtter væsketerapi, og grunnlaget for å gi væske er basert på patofysiologisk forståelse. Opprettholdelse av adekvat arteriell oksygendistribusjon er viktig fordi det minimerer iskemi. Mekanisk ventilering (endotrakeal tube eller maske) bør etableres hurtig hvis det er indisert. Blodsukkeret bør holdes under 10 mmol/L hvis det er mulig, samtidig bør man unngå hypoglykemi (23).
Revaskularisering
Fibrinolyse har begrenset effekt og er derfor reservert for situasjoner der PCI ikke er tilgjengelig eller transporttiden vil betydelig forsinke behandlingen (24). Aggressiv invasiv diagnostikk og behandling reduserer mortaliteten på kort og lang sikt (25). The SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK (SHOCK)-studien viste at pasienter som ble revaskularisert enten gjennom PCI eller aortokoronar bypass-operasjon hadde en 13 % økning i ett års overlevelsesrate (10, 26). Sammenliknet med initial medisinsk behandling og stabilisering var «numbers needed to treat» for å redde et liv < 8 (5). En ufullstendig randomisert sveitsisk studie (Swiss Multisenter Study of Angioplasty for Shock (SMASH)) viste liknende resultater (27).
Det er gjennomført en rekke registerbaserte studier som konkluderer med at tidlig revaskularisering reduserer mortaliteten signifikant, både for yngre og eldre pasienter (4, 6, 7, 8.) I SHOCK-studien var utkomme (overlevelse og livskvalitet) likt for aortokoronar bypass-operasjon og PCI (28, 29). På tross av disse studiene finnes det ikke en klar revaskulariseringsstrategi for pasienter med flerkarsykdom (28). Dette utgjør en betydelig utfordring siden flerkarsykdom er en hyppig tilstand ved kardiogent sjokk. 87 % av pasientpopulasjonen i SHOCK-studien hadde flerkarsykdom (30). Nåværende retningslinjer anbefaler PCI mot multiple kar for pasienter i kardiogent sjokk (aortokoronar bypass-operasjon er anbefalt for hemodynamisk stabile pasienter), og denne anbefalingen gjennomføres i omtrentlig 1/3 av tilfellene (28, 30). Det er viktig å nevne at det ikke finnes randomiserte kliniske studier med overbevisende data som understøtter den potensielle nytten av PCI mot flere kar under kardiogent sjokk. Uten RCT-er bør grunnlaget for beslutningen om å gjøre flerkar-PCI, i tillegg til intervensjon mot culprit lesion, være basert på lesjonens morfologi, predikert suksessrate, mistanke om iskemi i hvile, karets tilførselsomfang og pasientens hemodynamikk (5). Persisterende kardiogent sjokk etter gjennomført PCI mot culprit lesion er indikasjon for å utføre intervensjon mot resterende lesjoner. Alternative behandlingsmodaliteter er stegvis PCI-behandling eller aortokoronar bypass-operasjon (stegvis eller øyeblikkelig på vital indikasjon).
![]()
Mekaniskmstøttebehandling Intra-aorta-ballongpumpe (IABP)
IABP er den hyppigst benyttede mekaniske støttebehandling i dag og har vært benyttet ved behandling av kardiogent sjokk i rundt 40 år. Dog ble IABP bare brukt i 25- 40 % av tilfellene med kardiogent sjokk internasjonalt, ifølge en oversikt fra 2010, og bruken kan ha endret seg ytterligere etter senere negative studieresultater) (5) (5)
Ballongkateteret innlegges perkutant via arteria femoralis og føres opp til aorta thoracalis.
Virkningsmekanismen er en diastolisk inflasjon og hurtig systolisk deflasjon av ballongen ved bruk av heliumgass. En konsoll som overvåker hjertesyklus, kontrollerer pumpen, og følgelig er behandlingen mest effektiv under regelmessig hjerterytme. Motpulsasjonen fra pumpen senker endesystolisk trykk og øker topptrykket under diastolen, hvilket fører til en reduksjon av afterload, forbedret koronar perfusjon og reduksjon av myokardiell oksygenforbruk (31). Grunnet motpulsasjonen er IABP kontraindisert ved alvorlig aortainsuffisiens. Dessverre er det liten forbedring av minuttvolum, og det er ikke klarlagt om det er nok til å redusere mortaliteten (31).
I den moderne, invasive æra har IABP blitt tilgjengelig i norske sykehus på en langt større skala enn tidligere. Pumpen var tidligere kun tilgjengelig ved sykehus som hadde hjertekirurgisk kompetanse, og mens indikasjonen tidligere kun var støtteterapi før og etter åpen hjertekirurgi, er nå hovedindikasjonen kardiogent sjokk som kompliserer akutt hjerteinfarkt.
Samtidig har bruk av IABP som profylaktisk støtte under store fremreveggsinfarkt blitt mindre vanlig. Nylig viste en randomisert studie (CRISP-akutt hjerteinfarkt) at IABP-støtte ikke bidrar til å redusere størrelsen av infarktet ved store fremreveggsinfarkt uten kardiogent sjokk (32).
For pasienter som skal behandles med PCI er det optimale tidspunkt (før eller etter PCI) for innleggelse av IABP ikke avklart grunnet motstridende funn og få studier (33, 34). I IABP-SHOCK II fant man ingen forskjell i mortalitet mellom før og etter PCI (35). En liten studie (n=48) fra 2010 som sammenliknet innleggelse av IABP før og etter PCI hos pasienter med AMI og KS, fant lavere 30-dagers mortalitet hos gruppen som fikk IABP før PCI (19 versus 69 %) (34).
I starten var IABP-terapi ofte forbundet med alvorlige komplikasjoner som tromboembolisme, skader mot aorta, blødning og infeksjon (rapporterte risikofaktorer inkluderer kvinnelig kjønn, liten kroppsstørrelse og perifer vaskulær sykdom). Utstyrsforbedringer har gjort behandlingen langt tryggere. I nye, store registre ligger hyppigheten av alvorlige komplikasjoner på 2,8 %, mens hyppigheten av alle komplikasjoner ligger på 7,8 % (36).
Det vitenskapelige grunnlaget for bruk av IABP har alltid vært begrenset, og evidensen stammer hovedsakelig fra registerstudier. I SHOCK-studien kunne man vise til lavere sykehusmortalitet for pasienter som fikk kombinert behandling med IABP og tidlig revaskularisering (37). I studien Global Utilization of Streptokinase and TPA for Occluded Arteries (GUSTO-1) fant man lavere 30-dagers og ettårs totalmortalitet for akutt hjerteinfarktpasienter behandlet med IABP og trombolyse. I samme studie var IABP dessverre forbundet med økt risiko for uønskede hendelser og blødning (38). Registerdata fra American National Registry of Myocardial Infarction finner lavere mortalitet når IABP-terapi kombineres med trombolyse, men ikke for PCI (39).
Man håpet at den største og mest omfattende IABP-studien til dags dato, den randomiserte, kliniske studien Intraaortic Balloon Pump in Cardiogenic Shock II (IABP- SHOCK II), ville bekrefte de positive virkningene av IABP-terapi (35). Den viste isteden at rutinemessig bruk av IABP på pasienter med akutt hjerteinfarkt komplisert med kardiogent sjokk som gjennomgår revaskularisering, sammenliknet med standardterapi, ikke forbedrer overlevelsen. I tillegg var der ingen signifikant forskjell i noen av de sentrale, sekundære endepunkter som inkluderte hemodynamikk, nyrefunksjon, laktatstigning og CRP-stigning. Det var dog en ikke-signifikant trend mot at yngre pasienter og pasienter med førstegangsinfarkt fikk et bedre utkomme med IABP-terapi.
Å gjennomføre randomiserte studier som ser på kardiogent sjokk og IABP, har vist seg å være svært vanskelig, og man finner en rekke mulige feilkilder i SHOCK II. Selv om studien er ambisiøs, viser det seg at studiepopulasjonen er for liten (n=600) til å være konklusiv, og kohorten med en 30-dagers mortalitet på 40 % regnes for å være en populasjon med middels risiko for død. Resultatene kan således ikke overføres til høyrisikopasienter, og overlevelsesraten i studien reflekterer hurtig revaskularisering. Man ville ha forventet en forbedring av overlevelsesraten, ettersom nød-PCI og medisinsk behandling stadig forbedres. I lys av dette gjennomførte forfatterne en post-hoc-analyse som ikke viste noen forbedring av overlevelse for pasienter med blodtrykk under 80 mm Hg (40). Et annet viktig moment er den høye andelen av overkrysning av pasienter fra kontrollgruppen til IABP-gruppen. Det kan ha påvirket ”intention-to-treat”-analysen, men forfatterne gjennomførte en tilpasset analyse ved å ekskludere overkrysserne og fikk liknende resultater.
En Cochrane metaanalyse fra 2015 som undersøkte relevante RCT-er (7 studier, inkludert IABP-SHOCK II. N= 790) konkluderte med at IABP-behandling under AMI som kompliseres av KS kan ha positiv innvirkning på noen hemodynamiske parametere, men der finnes ingen overbevisende randomiserte data som støtter bruk av IABP under nevnte tilstand (41).
I juni 2015 publiserte JAMA (42) en omfattende metaanalyse der man undersøkte nytteeffekten av IABP ved akutt hjerteinfarkt, som viste nedslående resultater. Etter gjennomgang av 12 RCT-er fant man ingen påvisbar bedring av mortaliteten, uavhengig av om pasienten hadde kardiogent sjokk eller ikke. Forfatterne gjennomgikk også 15 observasjonsstudier. I motsetning til RCT-ene var resultatene i de store observasjonsstudiene sprikende. Det kunne se ut til at pasienter med kardiogent sjokk som fikk IABP hadde lavere mortalitet. Forfatterne mener at de ved å undersøke pasientenes karakteristika ved inklusjonstidspunktet har kunnet påvise en tydelig forskjell mellom pasientenes utgangspunkt. I flertallet av disse studiene hadde pasientene som mottok IABP en bedre utgangsprofil hva angår risikofaktorer for død enn pasientene som ikke fikk IABP.
IABPs rolle i behandling av kardiogent sjokk er blitt utfordret som følge av resultatene i SHOCK II samt resultater fra metaanalyser og manglende evidens andre steder. Før 2012/ 2013 støttet europeiske og amerikanske retningslinjer IABP-behandling av kardiogent sjokk med en klasse I anbefaling. ESCs retningslinjer fra 2012 endret sin anbefaling for rutinebruk av IABP ved KS til klasse II b med evidensnivå B (43), og til klasse III A i 2014 (44). Det anbefales videre at kortvarig mekanisk støttebehandling kan vurderes for pasienter med ACS og kardiogent sjokk (Klasse IIB C). I tillegg bør man vurdere IABP når det gjelder pasienter som er hemodynamisk ustabile/i kardiogent sjokk grunnet mekaniske komplikasjoner (Klasse IIa C) (44). AHA/ACC sine retningslinjer fra 2013 har en klasse IIa anbefaling, med evidensnivå B: IABP-behandling kan være gunstig for pasienter med kardiogent sjokk etter STEMI, som ikke lar seg hurtig stabilisere farmakologisk (23).
Oversikt over annen mekanisk støtteterapi
Det finnes en rekke andre apparater eller «devices» som enten brukes eller utprøves til behandling av kardiogent sjokk:
TandemHeart™ er et perkutant apparat som trekker arterielt blod fra venstre atrium til arteriell sirkulasjon ved å bruke et kateter som føres inn via vena femoralis med krysning av atrieseptum. Blodet returneres til arteriell sirkulasjon via retrograd perfusjon gjennom et kateter plassert i arteria femoralis. Indikasjoner for TandemHeart™ inkluderer midlertidig sirkulatorisk støtte under høy-risiko-PCI eller i påvente av forbedret ventrikkelfunksjon. Potensielle komplikasjoner ved TandemHeart™ er tamponade, ekstremitets-iskemi, stor blødning, sepsis, arytmi, og vedvarende atrieseptum defekt.
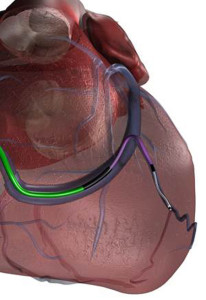
Impella® 2.5, CP og 5.0 er et perkutant (eller kirurgisk) støtteapparat for venstre ventrikkel (LVAD: Left Ventricular Assist Device). Denne føres via arteriell sirkulasjon, gjennom aortaklaffen og inn i venstre ventrikkel. Den virker gjennom en mikroaksial pumpe som roterer i høy fart og trekker blod ut av venstre ventrikkel og forbi enden av pumpen som munner ut i aorta ascendens. Potensielt kan Impella ® øke minuttvolumet med 2,5, 3,5 eller 5,0 l/min. En annen potensiell gunstig effekt er dekompresjon av venstre ventrikkel, noe som forhåpentligvis senker myokards oksygenbehov og øker perfusjonen i både koronararterier og endeorganer. Sammenliknet med IABP trengs et større kateter for å oppnå tilgang, og det tar lenger tid før behandlingen starter.
Et annet alternativ er å bruke perkutan kardiopulmonal bypass og gjennomføre ekstrakorporal membranøs oksygenering (ECMO). Med veno-arteriell «bypass» vil den ekstrakorporale pumpen gi støtte til systemisk perfusjon og kunne behandle både sirkulatorisk og respiratorisk svikt. ECMO er kontraindisert ved alvorlig aortainsuffisiens, alvorlig perifer karsykdom, blødningstendens, nylig gjennomgått cerebrovaskulær hendelse/hodeskade og sepsis.
Det er lite evidens og klinisk erfaring med perkutane LVAD ved kardiogent sjokk, noe som gjør det vanskelig å vurdere nytten. De er per dags dato ikke førstelinjebehandling, og bruken er basert på individuell erfaring ved ulike spesialiserte sentre som Haukeland universitetssykehus (HUS) og Oslo universitetssykehus (OUS). En metaanalyse av tre randomiserte studier (med totalt 100 pasienter) som sammenliknet perkutane LVAD med IABP viste ingen signifikant forbedring av 30-dagersmortaliteten. To studier omhandlet TandemHeart™ og én Impella® (45, 46, 47, 48). Sammenliknet med IABP-behandling viste LVAD-terapi forbedret hemodynamikk (øket hjerteindeks, høyere arterielt middeltrykk og lavere pulmonalt kiletrykk). TandemHeart™-gruppen hadde flere blødningskomplikasjoner.
Andre relevante data kommer fra en multisenter registerstudie: 120 pasienter med kardiogent sjokk etter akutt hjerteinfarkt ble først behandlet med IABP og deretter med Impella 2,5®. 30-dagersmortaliteten var 64,2 % (49). Utover forventede komplikasjoner som tromboembolisme, skader mot aorta, blødning og infeksjon er det rapportert om moderat hemolyse og trombocytopeni under Impella-behandling (50).
Teoretisk burde LVAD-terapi være en god behandling av kardiogent sjokk ved å motvirke iskemi, hypotensjon og myokardiell dysfunksjon, men det er en rekke problemer assosiert med LVAD-behandling (5). Overflaten til de intraluminalt plasserte LVAD-ene kan fremprovosere SIRS som forverrer sjokkbildet og kan føre til multiorgansvikt. Ekstrakorporeal sirkulasjon øker også risikoen for SIRS, og i tillegg aktiverer man komplementsystemet og promoterer koagulasjon. I verste fall kan dette føre til disseminert intravaskulær koagulasjon og alvorlig blødning.
Oppsummering
Flere pasienter enn tidligere overlever akutt hjerteinfarkt komplisert av kardiogent sjokk. Det finnes solid evidens for at forbedret strategi, logistikk og teknikk for hurtig reperfusjon, først og fremst primær PCI, er den viktigste årsaken til dette (4, 6, 7, 8, 51).
Hvilken betydning aggressiv mekanisk støttebehandling har er fortsatt uavklart.
Etter over fire tiår med studier og klinisk bruk har man ikke klart å finne evidens for at IABP-behandling forbedrer mortaliteten ved kardiogent sjokk. IABP-behandling bør kombineres med koronar revaskularisering, og det er lite som taler for å benytte seg av IABP-terapi uten pågående kardiogent sjokk. Dette valget støttes av nye data (se tidligere under Behandling) hvor man ikke har kunnet påvise en gunstig effekt av profylaktisk IABP-behandling under store fremreveggsinfarkt (32). Ved høyspesialiserte sentra som HUS og OUS, har man tatt i bruk ressurskrevende og dyr behandling i form av LVAD-er som Impella ® og ECMO, uten overbevisende evidens. Det finnes et klart insentiv for å søke nye og mer originale måter å behandle kardiogent sjokk. Norske kardiologer bør nå vurdere om de skal fortsette å ta i bruk IABP. Den vedvarende bruken av IABP (og LVAD) kan, med tanke på den manglende evidensen, mistenkes å skyldes et ønske om å «foreta seg noe» i møte med en svært dødelig tilstand, eller såkalt «handlingsbias».
De europeiske retningslinjene anbefaler ikke lenger IABP-terapi som standard førstelinjebehandling ved PCI-behandling hos pasienter med KS.
En avgjørende årsak til denne beslutningen skyldes resultatene i IABP-SHOCK II. Det er derfor viktig å påpeke begrensningene til SHOCK II: høy andel overkrysning og muligheten for at de pasientene som fallerte hurtig ble ekskludert eller krysset over. Ved øyeblikkelig hjelp-PCI kan man argumentere med at rutinebruk av IABP-terapi utsetter pasientene for en unødvendig ekstra risiko for komplikasjoner.
Referanser
1. Goldberg RJ, Samad NA, Yarzebski J, Gurwitz J, Bigelow C, Gore JM. Temporal trends in cardiogenic shock complicating acute myocardial infarction. N Engl J Med 1999;340:1162–1168.
2. Holmes DR Jr, Bates ER, Kleiman NS, Sadowski Z, Horgan JH, Morris DC, et al. Contemporary reperfusion therapy for cardio- genic shock: the GUSTO-I trial experience. The GUSTO-I Investigators. Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries. J Am Coll Cardiol 1995;26:668–674.
3. Hasdai D, Behar S, Wallentin L, Danchin N, Gitt AK, Boersma E, et al. A prospective survey of the characteristics, treatments and outcomes of patients with acute coronary syndromes in Europe and the Mediterranean basin; the Euro Heart Survey of Acute Coronary Syndromes (Euro Heart Survey ACS). Eur Heart J 2002;23:1190–1201.
4. Goldberg RJ, Spencer FA, Gore JM, Lessard D, Yarzebski J. Thirty-year trends (1975 to 2005) in the magnitude of, management of, and hospital death rates associated with cardiogenic shock in patients with acute myocardial infarction: a population-based perspective. Circulation 2009;119:1211–1219.
5. Thiele H, Allam B, Chatellier G, Schuler G, Lafont A. Shock in acute myocardial infarction: the Cape Horn for trials? Eur Heart J 2010;31;1828-1835.
6. Thiele H, Schuler G. Cardiogenic shock: to pump or not to pump? Eur Heart J 2009;30:389-390.
7. The TRIUMPH Investigators. Effect of Tilarginine acetate in patients with acute myocardial infarction and cardiogenic shock. The TRIUMPH Randomized Con- trolled Trial. JAMA 2007;297:1657-1666.
8. Thom T, Haase N, Rosamund W, Howard VJ, Rumsfeld J, Manolio T, et al. Heart disease and stroke statistics- 2006 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcomittee. Circulation 2006;113: e85-151.
9. Goldberg RJ, Makam RC, Yarzebski J, McManus DD, Lessard D, Gore JM. Decade-long trends (2001–2011) in the incidence and hospital death rates associated with the in-hospital development of cardiogenic shock after acute myocardial infarction. Circ Cardiovasc Qual Outcomes 2016;9:117-125.
10. Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardio- genic Shock. N Engl J Med 1999;341:625-634.
11. Thiele H, Lauer B, Hambrecht R, Boudriot E, Cohen HA, Schuler G. Reversal of cardiogenic shock by percutaneous left-atrial-to-femoral arterial bypass assistance. Circulation 2001;104:2917–2922.
12. Thiele H, Sick P, Boudriot E, Diederich KW, Hambrecht R, Niebauer J, et al. Randomized comparison of intraaortic balloon support versus a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. Eur Heart J 2005;26:1276–1283.
13. Fincke R, Hochman JS, Lowe AM, Menon V, Slater JN, Webb JG, et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: a report from the SHOCK trial registry. J Am Coll Cardiol 2004;44:340-348.
14. Reynolds HR, Hochman JS. Cardiogenic shock. Current concepts and improving outcomes. Circulation 2008;117:686–697.
15. Lindholm MG, Kober L, Boesgaard S, Torp-Pedersen C, Aldershvile J. Cardiogenic shock complicating acute myocardial infarction: prognostic impact of early and late shock development. Eur Heart J. 2003;24:258-265.
16. Hochman JS. Cardiogenic shock complicating acute myocardial infarction: expanding the paradigm. Circulation. 2003;107:2998–3002.
17. Prondzinsky R, Lemm H, Swyter M, et al. Intra-aortic balloon counterpulsation in patients with acute myocardial infarction complicated by cardiogenic shock: the prospective, randomized IABP SHOCK Trial for attenuation of multiorgan dysfunction syndrome. Crit Care Med 2010;38:152-160.
18. Babaev A, Frederick PD, Pasta DJ, Every N, Sichrovsky T, Hochman JS. Trends in management and outcomes of patients with acute myocardial infarction complicated by cardiogenic shock. JAMA. 2005; 294: 448–454.
19. Jeger RV, Harkness SM, Ramanathan K, Buller CE, Pfisterer ME, Sleeper LA, et al. Emergency revascularization in patients with cardiogenic shock on admission: a report from the SHOCK trial and registry. Eur Heart J. 2006;27:664–670.
Viser til full referanseliste i Hjerteforum nr 1 2017.